钍基核裂变能全国重点实验室 |
|||
|
-钍基核能物理中心-
|
|||
熔盐机械工程技术部 |
|||
仪控工程技术部 |
|||
熔盐化学工程技术部 |
|||
|
-核能综合利用研究中心-
|
|||
材料研究部 |
|||
钍铀循环化学部 |
|||
应用化学技术部 |
|||
氚科学与工程技术部 |
|||
核与辐射安全技术部 |
|||
应用加速器技术部 |
|||
反应堆运行技术部 |
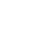



DNA纳米技术为纳米药物载体、纳米机器人研究提供了一系列强大的工具,已逐渐成为一种纳米医学研究的热点。近日,中国科学院上海应用物理研究所物理生物学研究室及上海光源生物成像中心樊春海和黄庆研究员合作,应用一系列先进的细胞显微成像技术并结合生物化学手段,清晰展示了一类自组装DNA四面体结构在活细胞中的摄取与转运过程,为其在药物载运和治疗方面的应用奠定了良好的基础。相关研究结果以封面论文的形式发表于《德国应用化学》杂志(Angew. Chem. Int. Ed. 2014, 53,7745-7750)。
DNA不仅仅是生命的密码,还可以作为制造纳米级构件和机器的通用元件。利用DNA分子的自组装特性,DNA纳米技术领域的研究者可以根据简单的核酸碱基配对法则设计并在试管中构造出精确而复杂的DNA纳米结构。在这个领域中,DNA往往被看作是一种非生物的材料而不是在活细胞中那样作为遗传信息的载体。尽管如此,由于自组装DNA纳米结构具有卓越的生物相容性,近年来研究者对于其生物医学应用产生了越来越浓厚的兴趣。DNA四面体结构是一类重要的自组装DNA纳米结构。2011年,樊春海和黄庆课题组在国际上首次报道了DNA四面体结构可以作为一种纳米尺度的药物载体,将具有免疫刺激效应的CpG寡核苷酸转运进入细胞并刺激产生特定的细胞因子,有望成为一种免疫治疗药物(ACS Nano 2011, 5, 8783-8789)。之后,国际上多个课题组相继报道了利用DNA纳米结构作为药物载体的工作。然而,细胞膜具有负电性,通常会将同样带有负电荷的核酸分子屏蔽在膜外。而这些DNA纳米结构如何穿越细胞膜屏障而进入细胞内则成为一个谜。