
钍基核裂变能全国重点实验室 |
|||
|
-钍基核能物理中心-
|
|||
熔盐机械工程技术部 |
|||
仪控工程技术部 |
|||
熔盐化学工程技术部 |
|||
|
-核能综合利用研究中心-
|
|||
材料研究部 |
|||
钍铀循环化学部 |
|||
应用化学技术部 |
|||
氚科学与工程技术部 |
|||
核与辐射安全技术部 |
|||
应用加速器技术部 |
|||
反应堆运行技术部 |



最近,在中国科学院外籍青年科学家项目(2009YA1-1)和国家科技部“973”项目(2007CB936000)的支持下,上海应用物理研究所物理生物学实验室外籍青年科学家Daniel Czajkowsky在多聚化Fc-融合蛋白研究和蛋白质与固体表面相互作用机理研究中取得新进展。
多聚化Fc-融合蛋白研究进展
Fc-融合蛋白是通过基因工程改造过的、包含免疫球蛋白Fc部分和目标蛋白的融合蛋白,同时拥有免疫球蛋白的特性和目标蛋白的特性。这些蛋白易于构建和生产,血清半衰期长,在制药领域拥有广阔前景。如一种称为“Etanercept”的 Fc-融合蛋白药物,2010年的年销售额达33亿美元。目前,科学家们正在努力寻求多聚化Fc-融合蛋白的方法,构建人工免疫复合体 (immune-complex),用于增强Fc-融合蛋白的效用。
为了寻找解决的方法, Daniel Czajkowsky等研究人员在获得IgM五聚体结构信息(Daniel Czajkowsky & 邵志峰, PNAS, 2009, 106, 14960) 的基础上,构建了多聚体Fc-融合蛋白,分别采用原子力显微镜和表面等离子共振技术验证了该复合体的稳定性以及与不同Fc受体的亲和性,并在细胞水平上证实了复合体与B细胞的结合能力。结果表明,这个多聚体复合物在药物和疫苗应用领域具有潜在的应用价值。
该研究由外籍青年科学家Daniel Czajkowsky与上海应用物理研究所物理生物学实验室、上海交通大学系统生物医学研究院邵志峰课题组、以及利物浦热带医学院的Dr. Richard Pleass合作完成,研究结果发表于Scientific Reports (Nature)(DOI:10.1038/srep00124)http://www.nature.com/srep/2011/111019/srep00124/full/srep00124.html ,图1)。
蛋白质与固体表面相互作用机理研究进展
固体材料在医疗和许多技术领域得到了越来越广泛的应用。然而,研究固体表面与纳米结构,如蛋白质、DNA 折纸、纳米粒子等的非共价键相互作用机理方面的手段和技术相对缺乏。Daniel Czajkowsky等研究人员在云母表面上构建了链霉亲和素二维晶体结构,详细解析了链霉亲和素—云母的作用力。利用高分辨的原子力显微镜图像,链霉亲和素所具有的六个正电荷的位置与云母表面一埃大小的阴离子穴位置近乎完美的匹配特征可清晰地识别出来。与结构模型比对发现,链霉亲和素的晶体取向为该表面的单一方向,而不是只与云母三折叠对称的顶层表面相互作用的三个不同晶体方向,也表明了链霉亲和素六个正电荷的前端质子必然穿过云母表面的阴离子穴与第二层的羟基相互作用来打破三折叠对称结构。研究表明,固体材料的二层原子可以显著地影响蛋白质的吸附以及方向,而且蛋白质的“质子手”可作为一种普遍的手段与固体表面相互作用,这对人们设计合理的固体表面,以期实现和促进特定的纳米结构吸附具有重要的指导意义。
该研究由外籍青年科学家Daniel Czajkowsky、上海应用物理研究所物理生物学实验室李林博士、上海交通大学系统生物医学研究院邵志峰实验室合作完成,文章发表在美国化学学会的ACS Nano杂志(ACS Nano, 2012,6 (1),pp 190–198. 图2、图3)。
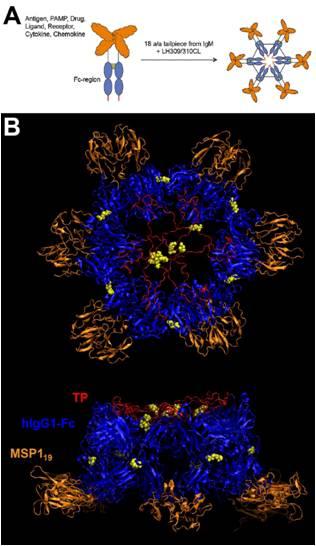
图1:多聚体Fc-融合蛋白示意图
图2. 链霉亲和素在云母表面上的二维晶体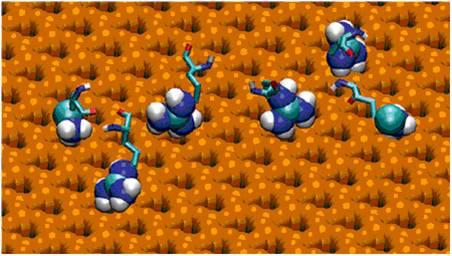
图3. “质子手”与固体表面的相互作用