



一、CRISPR-Cpf1细菌免疫系统研究
2016年4月20日,国际权威学术期刊《自然》(Nature)在线发表哈尔滨工业大学黄志伟教授团队的文章:“The crystal structure of Cpf1 in complex with CRISPR RNA(CRISPR-Cpf1结合crRNA的复合物晶体结构)”。该项研究通过结构生物学和生化研究手段揭示了CRISPR-Cpf1识别CRISPR RNA(crRNA)以及Cpf1剪切pre-crRNA成熟的分子机制,这对认识细菌如何通过CRISPR系统抵抗病毒入侵的分子机理具有十分重要的科学意义,而且为成功改造Cpf1系统,使之成为特异的、高效的全新基因编辑系统提供了结构基础,让人们可以更加高效地对目的基因进行“关闭”、“恢复”和“切换”等精准“手术”,使战胜癌症和艾滋病等疾病成为可能。
CRISPR-Cas系统是细菌编码的适应性免疫系统,该系统通过RNA引导的效应蛋白剪切病毒的DNA或者RNA从而抵抗病毒的感染。该系统之一的CRISPR-Cas9系统被用来作为可编程的基因编辑工具用于细胞内目的DNA的剪切、激活表达、修饰、突变等。由于CRISPR-Cas9系统能够在活细胞中高效地、便捷地“编辑”任何基因,作为科研、医疗等领域的强有力工具,已被广泛地应用于全世界的生物和医学实验室。
刚刚发现的CRISPR-Cpf1系统是一类新型的CRISPR-Cas系统,能够在crRNA引导下在人类细胞内剪切目的DNA底物。而且Cpf1本身也是一个具有序列特异性的RNase,这也是目前发现的唯一一个具有核酸序列特异性且同时具有DNase和RNase活性的核酸酶。Cpf1和Cas9很大的不同还在于:Cpf1仅需要一个拷贝的crRNA,而Cas9需要序列更长的tracrRNA和crRNA去识别、剪切底物DNA,较短的crRNA在转染细胞过程中将更高效;Cpf1和Cas9识别DNA底物上的模块(PAM)也不同;Cpf1剪切底物是通过粘性末端剪切,而Cas9是末端剪切,粘性末端剪切将更有利于基因编辑后的修复。
在该项研究中,黄志伟教授团队利用上海光源生物大分子晶体学线站(BL17U1)首次解析了结合了crRNA的Cpf1复合物的晶体结构。非常意外的是,Cpf1并不是之前人们推测的二聚体状态,而是一个呈三角形的单体,位于该结构中间是一个带有正电荷的凹槽。crRNA通过发卡结构形成高度扭曲的构象紧密结合在Cpf1的核酸结合结构域,和底物DNA配对的crRNA 3'末端位于Cpf1凹槽的一端。和Cas9结合的sgRNA显著不同的是,Cpf1结合的crRNA的引导序列部分(guide sequence)并没有电子密度,这说明在没有底物结合的状态下这部分序列和Cpf1的结合比较松散。据黄志伟教授介绍,结构观察发现一个紧密结合crRNA的六水合镁离子对稳定crRNA构象激活Cpf1的催化活性非常关键。通过比较Cpf1和Cas9复合物的结构发现,LHD区域推测可能是双链DNA底物结合的PAM区域。
该研究发现Cpf1在没有crRNA结合的状态下处于松散的构象,crRNA的结合引起Cpf1发生显著的构象变化。与Cas9结合sgRNA极为不同的是,仅仅crRNA的重复序列部分(repeat sequence)就能引起Cpf1构象的巨大变化,这反映了这类短小的crRNA与Cas9结合的长sgRNA的识别机制的巨大差别。该结构显示来自于H843、 K852以及K869催化残基侧链上的氮原子位于一个平面上,同时和RNA A(+20)的磷酸基团形成氢键,该结构证据表明Cpf1剪切pre-crRNA成为crRNA是一个碱催化的反应。
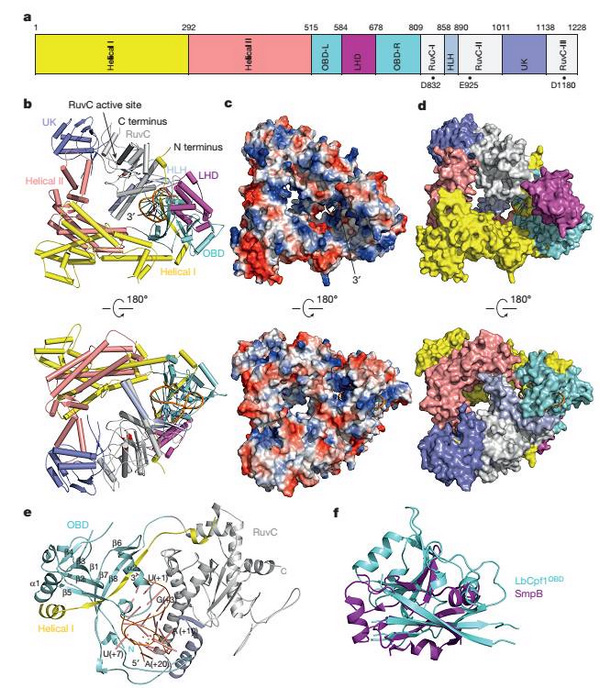
图:CRISPR-Cpf1结合crRNA的复合物晶体结构
二、寨卡病毒蛋白结构与致病机制研究
中国科学院微生物研究所施一研究员和高福院士团队通力合作,在揭示寨卡病毒致病机制方面取得重要进展,研究结果以“Zika virus NS1 structure reveals diversity of electrostatic surfaces among flaviviruses(寨卡病毒NS1结构揭示不同黄病毒NS1存在不同的表面电荷分布)”为题于2016年4月18日在线发表在国际权威学术期刊Nature Structural & Molecular Biology上。
寨卡病毒属黄病毒科黄病毒属,通过伊蚊传播,于1947年首次在非洲分离,后来常在亚洲和非洲部分热带地区暴发和传播,但是由于人感染后症状很轻一直被科学界忽略。2013年在法国玻里尼西亚暴发后,病毒迅速蔓延到美洲,已波及南美、加勒比海地区25个国家和地区。与此同时越来越多的证据表明寨卡病毒与胎儿和新生儿的小头畸形症及严重的神经系统并发症如格林巴利综合症有关。寨卡病毒可以在怀有小头畸形症胎儿的孕妇的羊水以及小头畸形症新生儿的脑组织中检测到。此外,寨卡病毒可以感染人神经祖细胞并导致细胞死亡。目前临床上还没有可用的疫苗和特效治疗药物来预防和控制寨卡病毒感染。
寨卡病毒与其它黄病毒属成员一样,基因组为单股正链RNA,由单一的开放读码框编码3个结构蛋白(C、prM/M和E),及7个非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)。其中NS1是病毒唯一分泌并与宿主相互作用的重要蛋白,在病毒感染、复制、病理及免疫逃逸过程中起着重要作用。NS1在细胞内形成同源二聚体,与胞内膜系统的脂类结合,参与病毒复制,同时NS1还可形成由3个二聚体组成的同源六聚体,以可溶性形式分泌于胞外,通过与宿主免疫系统及其它宿主因子的相互作用帮助病毒免疫逃逸及加强致病性,同时NS1可诱导机体产生抗体,是病毒感染的主要抗原,也是病毒早期诊断的重要标志物。
研究团队利用上海光源生物大分子晶体学线站(BL17U1)率先解析了寨卡病毒非结构蛋白NS1的C端三维结构,发现其形成棒状的同源二聚体结构,一面由20个反平行的β折叠形成梯形结构,另一面由复杂的环状结构组成。与同属的西尼罗病毒(WNV)和登革病毒(DENV)的NS1蛋白结构相比,寨卡病毒NS1的整体结构很相似,但是在环状结构表面却存在不同的表面电荷分布特征。DENV I型和II型的NS1在环状结构表面的中心区域呈现正电荷分布,WNV的NS1则呈现负电荷分布,而寨卡病毒的NS1则既有正电荷又有负电荷。此区域正是位于NS1六聚体桶状结构的外侧,完全暴露在外面,为NS1与宿主相互作用的主要界面,也是抗体靶向的关键区域。此区域不同的表面电荷分布特征极有可能与不同黄病毒的致病模式不同有关,提示应该从NS1着手去研究其与小头畸形症、神经系统并发症的关系。
这些研究极大丰富了人们对寨卡病毒的认识,为应对寨卡病毒疫情及防控提供了重要的理论基础。(生命科学研究部 供稿)
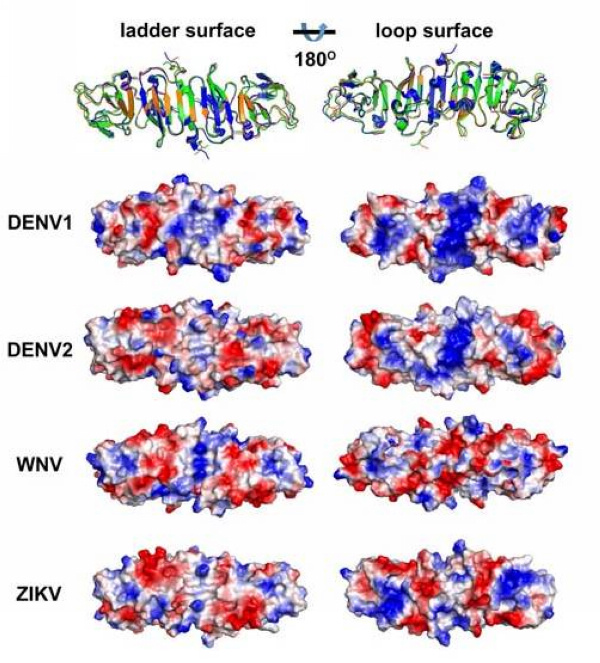
图:寨卡病毒NS1与其它黄病毒NS1结构比较,揭示了不同黄病毒NS1存在不同的表面电荷分布特征